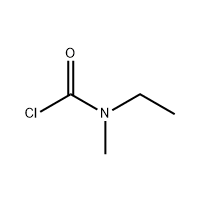
3'-аміно-2'-гідрокси-[1,1'-біфені]-3-карбонова кислота
3'-аміно-2'-гідрокси-[1,1'-біфені]-3-карбонова кислота
3'-аміно-2'-гідрокси-[1,1'-біфені]-3-карбонова кислота використовується як проміжний продукт ельтромбопагу.
Елтромбопаг, розроблений компанією GlaxoSmithKline (GSK) у Великобританії, а пізніше спільно з Novartis у Швейцарії, є першим і єдиним схваленим непептидним агоністом рецептора TPO з невеликою молекулою у світі.У 2008 році FDA США схвалив ельтромбопаг для лікування ідіопатичної тромбоцитопенічної пурпури (ІТП), а в 2014 році — для лікування тяжкої апластичної анемії (АА).Це також перший препарат, схвалений FDA США для лікування АА за останні 30 років.
У грудні 2012 року FDA США схвалило ельтромбопаг для лікування тромбоцитопенії у пацієнтів із хронічним гепатитом С (ХГС), щоб пацієнти з гепатитом С із поганим прогнозом через низький рівень тромбоцитів могли почати та підтримувати стандартну терапію захворюваннями печінки на основі інтерферону.3 лютого 2014 року компанія GlaxoSmithKline оголосила, що FDA визнало ельтромбопаг проривним препаратом для лікування гемопенії у пацієнтів із важкою хімічною апластичною анемією (SAA), які не повністю відповіли на імунотерапію.24 серпня 2015 року FDA США схвалило ельтромбопаг для лікування тромбоцитопенії у дорослих і дітей віком від 1 року з хронічною імунною тромбоцитопенією (ІТП), у яких недостатня відповідь на кортикостероїди, імуноглобуліни або спленектомію.4 січня 2018 року ельтромбопаг було схвалено для включення в Китай у список препаратів для лікування первинної імунної тромбоцитопенії (ІТП).


![3'-аміно-2'-гідрокси-[1,1'-біфені]-3-карбонова кислота](http://cdn.globalso.com/jindunchem-med/image351.png)
![3'-аміно-2'-гідрокси-[1,1'-біфені]-3-карбонова кислота](http://cdn.globalso.com/jindunchem-med/image351-300x300.png)
![6-тетра-О-актеїл-1-С-[4-хлор-3-[[4-[[(3S)-тетрагідрофуран-3-іл]окси]феніл]](http://cdn.globalso.com/jindunchem-med/0ecf55f0-300x300.jpg)